1. Introducció
El 1884 el químic suec Arrhenius afirma en la teoria de dissociació iònica que, en dissolució aquosa, algunes substàncies es dissocien en ions positius i ions negatius que les fa conductores de l’electricitat.
Segons Arrhenius, un àcid és una substància que en dissolució aquosa es dissocia formant ions hidrogen (\(H^+\)) i una base es dissocia formant ions hidroxil (\(OH^-\)).
\(
AH + H_2 O ⇌ A^- + H^+
\\
BOH + H_2 O ⇌ B^+ + OH^-
\)
Però hi ha substàncies que es comporten com a àcids o com a bases en dissolvents que no són aigua o que no es dissocien en aquests ions.
El 1923, Brönsted i Lowry ampliaren de forma independent la definició d’àcid i base d’Arrhenius dient que, un àcid és una espècie química que pot proporcionar ions \(H_ 3 O^+\) i una base en pot acceptar.
Quan un àcid perd un protó es forma la base conjugada, i quan una base en rep un és forma l’àcid conjugat de la base:
\(
HA \text{(Àcid)} ⇌ A^- \text{(Base conjuagada)} + H^+
\\
BOH \text {(Base)} ⇌ B^+ \text { (Àcid conjugat)} + OH^-
\)
Més tard, Lewis amplia encara més la definició i diu que un àcid és una substància que pot acceptar un parell d’electrons i una substància bàsica proporciona un parell d’electrons.
Tanmateix, les substàncies sols mostraran el caràcter àcid o bàsic quan reaccionin amb altres substàncies que puguin rebre o donar protons. Hi ha substàncies, com l’aigua, que de vegades tenen caràcter àcid o bàsic segons la substància amb la qual reaccioni.
2. Equilibri iònic de l’aigua
La reacció d’ionització de l’aigua és una reacció en la qual una molècula d’aigua perd un protó i esdevé un ió hidroxil \((OH^-)\). El nucli d’hidrogen (\(H^+\)) agafa immediatament una molècula d’aigua per a formar un ió oxoni (\(H_3 O^+\)):
\(2H_2 O ⇌ H_3 O⁺ + OH^-\)
tot i que Arrhenius va proposar inicialment la reacció d’ionització
\(H_2 O ⇌ H⁺ + OH^-\)
A causa de l’autoionització, l’aigua té una conductivitat elèctrica de 0.055 μS/cm.
La constant d’equilibri d’aquesta reacció és:
\(\displaystyle K_e=\frac{[ H_3 O^+] \cdot [OH^-]} {[H_2 O]^2}\)
A 25 ºC les concentracions d’ions hidroni i hidroxil són iguals:
\([H_3 O^+]=[OH^-]=1×10^{-7}\)
I si calculem \(H_2 O\) a partir de la densitat de l’aigua a 25ºC:
\(\displaystyle [H_2 O]=0,997 \frac{g}{mL} \cdot {\frac{ 1 mol} {18g}} \cdot { \frac{1000 mL}{1L} }~=55,3 M\)
Com que hi ha molt poques molècules dissociades, aproximadament 2 ppb, la reacció d’autoionització està desplaçada molt cap a l’esquerra i, per tant, la concentració d’aigua pràcticament no varia:
\(\displaystyle K_e \cdot [H_2 O]^2={[ H_3 O^+] \cdot [OH^-]} \rightarrow K_w={[ H_3 O^+] \cdot [OH^-]}=10^{-14}\)
3. Grau d’acidesa (pH o potencial d’hidrogen)
L’acidesa és la capacitat d’una substància de proporcionar protons en solució aquosa.
L’escala de pH es defineix usant un elèctrode d’hidrogen o de vidre en contacte amb la solució estudiada i un altre elèctrode de referència (de calomelans, per exemple). Un elèctrode de referència té un potencial de reducció estable i conegut. L’estabilitat del potencial de l’elèctrode s’aconsegueix mitjançant un sistema redox amb concentracions tampó.
El pH és una escala que varia logarítmicament de 0 (molt àcid) a 14 (molt poc àcid) en dissolucions aquoses:
\(pH=-log [H_3 O^+]\)
El pH de l’aigua pura és 7, però varia quan hi afegim un àcid o una base. Per la constant de l’aigua, quan augmenta la concentració d’ions oxoni, minva la d’hidroxils. La constant de l’aigua també varia amb la temperatura:
\(K_w=[H_3 O^+] \cdot [OH^-]=10^{-14}, pK_w=pH+pOH=14\)
El pH fou definit el 1909 pel químic danès Søren Peter Lauritz Sørensen.
4. Àcids i bases febles
Un àcid feble és un àcid que té poca capacitat de cedir protons. Una base feble és una base que té poca capacitat d’acceptar-los (l’àcid acètic o l’àcid carbònic són àcids febles i l’hidròxid d’amoni és una base feble, per exemple).
Un àcid/ base forta és un àcid/base que té molta capacitat de cedir/acceptar protons (l’àcid sulfúric o clorhídric són àcids forts i l’hidròxid de sodi o de potassi són bases fortes, per exemple).
Si l’àcid (\(HA\)) és feble, la base conjugada (\(A^-\)) serà forta (tindrà molta capacitat per a acceptar protons).
\(HA ⇌ A^- + H^+\)
En canvi, si l’àcid és fort, la base conjugada serà feble (tindrà poca capacitat per a acceptar protons).
\(HA \rightarrow A^- + H^+\)
De la mateixa manera, si una base és feble, l’àcid conjugat serà fort i a l’inrevés.
Els àcids o bases febles tenen constants de dissociació més petites que la unitat. Són reaccions de dissociació reversibles. En canvi, els àcids o bases fortes tenen constants de dissociació grans i són pràcticament irreversibles.
La constant d’equilibri d’un àcid feble és:
\(\displaystyle K_a=\frac{[A^-] \cdot [H^+]} {[HA]}\)
Similarment, la d’una base feble és:
\(\displaystyle K_b=\frac{[B^+] \cdot [OH^-]} {[BOH]}\)
Els claudàtors indiquen la concentració molar en l’equilibri de cada espècie.
A l’equilibri, la concentració d’ions hidrogen en un àcid és:
\(
\displaystyle
[ H^+ ]=[ A^- ], [H A]=C_{inicial àcid }-[ H^+ ] \rightarrow [ H^+ ]=\sqrt{ K_a(C_{inicial àcid }-[ H^+ ])}
\)
Si la concentració d’ions hidrogen és petita comparada amb la concentració inicial de l’àcid sense dissociar-se:
\(
[ H^+ ]=\sqrt{ K_a C_{inicial àcid}}
\\
[ HA ]~=C_{inicial àcid}
\)
(Vegeu l’entrada Equilibri Químic per a saber-ne més)
5. Efecte de l’ió comú
Com en qualsevol procés en equilibri, la ionització d’un àcid o d’una base feble pot estar influenciada per variacions de la concentració d’algun dels ions dissociats segons el principi de Le Chatêlier.
\(HAc ⇌ Ac^- + H^+\)
Per exemple, l’equilibri de la dissociació de l’àcid acètic es desplaçarà cap a l’esquerra si hi afegim ions acetat o un àcid, i es desplaçarà cap a la dreta si hi afegim una base.
Exemple:
\(
\displaystyle{
\text{Quant minva la } H^+ \text{ d’una dissolució 0,20M d’àcid acètic quan s’hi afegeix NaAc 0,10M?}
\\
~K_a=1,8×10^{-5}
\\[0.5cm]
H^+= K_a \cdot { \frac{[HAc]} {~[Ac^-]} }=1,8×10^{-5}
\\[0.5cm]
\text{Abans d’afegir-hi NaAc, }[H^+]=[Ac^-]\text {:}
\\[0.5cm]
[H^+]^2= K_a \cdot {[HAc]}=1,8×10^{-5} \cdot 0,20=\sqrt {3,6×10^{-6}M}=1,90×10^{-3}M
\\[0.5cm]
\text{Després d’afegir-hi NaAc:}
\\[0.5cm]
H^+= K_a \cdot { \frac{[HAC]} {~[Ac^-]} }=1,8×10^{-5} \cdot { \frac{0,20} {0,10} }=3,6×10^{-6}M
\\[0.5cm]
\text{De fet, la concentració d’} AcH\text{ en l’equilibri és } 0.20+[H^+] \text{ i la d’ } [Ac^-]=0.10-[H^+],
\\
\text{ però podem fer l’aproximació anterior sense gaire error.}
}
\)
Exemple:
\(
\displaystyle{
\text{Calculeu la concentració d’} H^+ \text{d’una dissolució formada per volums iguals d’HCl 0,10M}
\\
\text{i NaAc 0,40M.}
\\[0.5cm]
HCl \rightarrow H^+ (0,1M ) + Cl^-
\\
NaAc \rightarrow Na^+ + Ac^- ( 0,40M )
\\[0.5cm]
\text{Quan es barregen l’àcid clorhídric i l’acetat sòdic, 0,10mols de l’acid reaccionen amb}
\\
\text{ 0,10 mols de la sal i s’estableix l’equilibri:}
\\[0.5cm]
\begin{matrix}
Ac^- & + & H^+ & ⇌ & HAc \\
(0,40-0,10):2 & + & H^+ & ⇌ & 0,10:2\end{matrix}
\\
[ H^+]=K_a \cdot { \frac{[HAc]} {[Ac^-] }}=1,8×10^{-5} \cdot {\frac{0,050} {0,15}}=6,0×10^{-6}M
\\[0.5cm]
\text{Les concentracions en l’equilibri d’acetat i HAc s’han de dividir per dos perquè s’afegeixen}
\\
\text{volums iguals de cada reactiu.}
\\[0.5cm]
\text{De fet, }[ HAc ]=0,050-[H^+] \, i \, [ Ac^- ]=0,15+[H^+] \text{, però la concentració d’ions hidrogen és}
\\
\text{tan petita comparada amb la d’àcid i d’acetat que l’error que fem menyspreant-la}
\\
\text{és molt petit.}
}
\)
(Vegeu l’apartat 7. Hidròlisi d’aquest document)
6. Dissolucions amortidores, reguladores o tampó
Les dissolucions amortidores, reguladores o tampó són dissolucions el pH de les quals varia molt poc per dilució o addició de quantitats moderades d’àcids o de bases, fins i tot forts. Una solució està amortida, tamponada o regulada si s’oposa a la modificació de la concentració d’ions oxoni.
Estan formades per un àcid o una base feble i una de les seves sals fortament ionitzada.
Un compost que tingui a la vegada propietats àcides o bàsiques pot ser regulador de pH.
Per exemple, una dissolució de bicarbonat (\(HCO_3 ^-\)) té acció reguladora a causa d’aquest ió que pot cedir o acceptar protons quan reacciona amb altres àcids o bases:
\(
H CO_3^- + OH^- ⇌ H_2 O + CO_3^{–}
\\
H CO_3^- + H^+ ⇌ H_2 CO_3
\)
En general, les sals d’àcids polipròtics febles tenen acció reguladora petita.
Exemple:
\(
\displaystyle{
\text{La constant d’ionització d’un àcid feble és } K_a=1,0.10^{-5}.
\\
\text{Es preparen dues solucions 0,10M, una d’aquest àcid i l’altra de la seva sal sòdica.}
\\
\text{Calculeu el pH de la solució original i de la solució després d’afegir-hi 0,010 mols d’HCl }
\\
\text{i després d’afegir-hi 0,010 mols d’NaOH a un litre de solució reguladora.}
\\[0.5cm]
HA ⇌ H^+ + A^- \rightarrow [H^+]=K_a \cdot { \frac{[HA]}{ [A^-] }} \rightarrow pH=pK_a+log{\frac{[A^-]} {[HA]}}
\\[0.5cm]
\text{a) Abans d’afergir-hi l’àcid o la base:}
\\[0.5cm]
pH=pK_a+log{\frac{[A^-]} {[HA]}}=5+log{\frac{ 0,1 }{ 0,1 }}=5
\\[0.5cm]
\text{b) Després d’afegir-hi l’àcid l’equilibri es desplaçarà cap a l’esquerra:}
\\[0.5cm]
[ HA ]= 0,11, \, [ A^- ]=0,09 \rightarrow pH=pK_a+log{\frac{[A^-]}{[HA]}}=5+log{\frac{ 0,09 }{ 0,11 }}=4,91
\\[0.5cm]
\text{c) Després d’afegir-hi la base l’equilibri es desplaçarà cap a la dreta:}
\\[0.5cm]
[ HA ]= 0,09, \, [ A^- ]=0,11 \rightarrow pH=pK_a+log{\frac{[A^-]}{[HA]}}=5+log{\frac{ 0,11 } { 0,09 }}=5,09
}
\)
7. Hidròlisi
La hidròlisi és la descomposició d’una substància per l’acció de l’aigua sense transferència d’electrons. La sal d’un àcid feble i d’una base forta, la d’una base feble i d’un àcid fort i la d’un àcid i una base febles tenen tendència a hidrolitzar-se. Si és una reacció irreversible, la hidròlisi és completa:
\(PCl_3 + 3H_2 O \rightarrow 3HCl + H_3 PO_3\)
Però si la reacció és reversible, com en el cas d’algunes sals, s’estableix un equilibri:
7.1 D’una reacció d’anions d’àcids febles
\(
\displaystyle{
A^- + H_2 O ⇌ HA + OH^-
\\
K_{conjuagada}= \frac{[HA][OH^-]} {[A^-]}
}
\)
En una reacció d’hidròlisi intervenen dues reaccions d’equilibri, la \(A^-\) de la sal i la \(OH^-\) de l’aigua, les quals competeixen pels \(H^+\) :
\(
\displaystyle{
HA ⇌ A^- + H^+
\\
H_2 O ⇌ OH^-+ H^+
\\[0.5cm]
K_a=\frac{[ H^+ ][A^-]} {[HA]} \rightarrow [ H^+ ]= K_a \cdot \frac{[HA]} {[A^-]} \, i,
\\
K_{H_2 O}=[ H^+ ][ OH^-] \rightarrow [ H^+ ]= \frac{K_{H_2 O}} {[ OH^-]}
\\
K_a \cdot \frac{[HA]} {[A^-]}=\frac{K_{H_2 O}} {[ OH^-]} \rightarrow [HA][ OH^-]=\frac{K_{H_2 O}} {K_a} [A^-]
\\
\text{Quan s’arriba a l ‘equilibri:} [HA]=[ OH^-] \rightarrow [ OH^-]=\sqrt{\frac{K_{H_2 O}} {K_a} [A^-]}
\\
pH=14-pOH
\\[0.5cm]
\text{O bé:}
\\[0.5cm]
K_{hidròlisi}=\frac{[HA][OH^-]} {[A^-][H_2 O]} \rightarrow K_{conjugda}=\frac{[HA][OH^-]} {[A^-]}
\\
[ OH^-]=\sqrt{K_{conjugada} \cdot [ A^- ]}=\sqrt{\frac {K_{H_2 O}} {K_a} \cdot [ A^- ]}
\\
pH=14-pOH
}
\)
7.2 D’una reacció de cations de bases febles
\(B^++H_2 O ⇌ BOH+ + H^+\)
En aquest cas, \(B^+\) i els \(H^+\) de l’aigua competeixen pels \(OH^-\):
\(
\displaystyle{
BOH ⇌ OH^- +B^+
\\
H_2 O ⇌ OH^-+ H^+
\\[0.5cm]
[ H^+]=\sqrt{ K_{conjugada} \cdot [ B^+ ]}=\sqrt{\frac {K_{H_2 O}} {K_b} \cdot [ B^+ ]}
\\
pH=-log(\sqrt{\frac {K_{H_2 O}} {K_b} \cdot [ B^+ ]})
}
\)
8. Neutralització (Valoracions àcid-base)
La reacció entre un àcid i una base produeix una sal i aigua:
\(HA +B(OH) ⇌ BA+ H_2 O\)
Hi ha diferents valoracions de neutralització depenent de la força de l’àcid i de la base.
Una valoració és possible si, l’error relatiu del canvi que indica el final de la reacció al volum de valorat, és de l’1 o el dos per mil (una o dues gotes -una gota=0,05 ml- de valorant en 50 ml de valorat).
És important saber el pH aproximat de neutralització d’una reacció per tal d’escollir bé l’indicador adequat.
En una reacció de neutralització:
\(V_{valorant} \cdot N_{valorant}=N_{valorat} \cdot V_{valorat}\)
En funció de la molaritat:
\(V_{valorant} \cdot (M_{valorant} \cdot \nu)=V_{valorat} \cdot (M_{valorat} \cdot \nu)\)
\(\nu\) és el nombre d’equivalents gram de la substància.
(Vegeu MESCLES I BARREGES, 1.3 Concentració per a saber-ne més.)
8.1 D’un àcid fort i una base forta
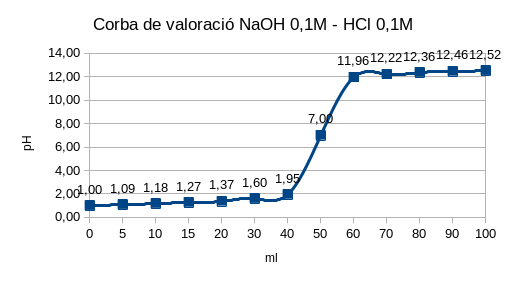
La reacció en aquest cas és \(H^+ + OH^- ⇌ H_2 O\). A la vora del punt estequiomètric, el canvi de pH és molt ràpid. La mesura del pH es fa amb un pH- metre o un potenciòmetre. El pH del punt final es pot detectar amb el canvi de color d’un indicador.
En una valoració sempre es compleix que:
\(
N_{valorant} \cdot V_{valorant}=N_{valorat} \cdot V_{valorat}
\\
M_{valorant} \cdot \nu_{valorant} \cdot V_{valorant}=
M_{valorat} \cdot \nu_{valorat} \cdot V_{valorat}
\)
Exemple:
\(
\displaystyle{
\text{Valoració de 50,00 ml de HCl 0,1 N amb NaOH 0,1 N -en aquest cas } \nu_{valorant}=\nu_{valorat}=1:
\\[0.5cm]
\text{A efectes de calcular el pH, la reacció és } H^+ + OH^-⇌ H_2 O
\\
\text{És a dir, que la concentració de NaOH és igual a la concentració d’} OH^-
\\
\text{i la concentració d’HCl és igual a la concentració d’H^+}
\\[0.5cm]
\text {a. Abans d’afegir la base:}
\\[0.5cm]
\text {Abans d’afegir la base el pH és el de la dissolució de clorhídric.}
\\
\text{Com que el clorhídric és un àcid fort, considerem que està}
\\
\text{completament dissociat. En aquest cas la normalitat és igual}
\\
\text{a la molaritat, i el pH=-log ( 0,1 )=1,00.}
\\[0.5cm]
\text {b. Quan s’han afegit 10,00 ml de NaOH:}
\\[0.5cm]
\text{Com que 1 meg (1 mol) de NaOH (OH^-) neutralitzarà 1 mol d´HCl} (H^+)
\\
\text{i el volum total de solució serà de 60,0 00 ml:}
\\[0.5cm]
[ H^+ ]=\frac{\text {mols HCl restants en dissolució}}{\text{Volum total dissolució}}
\\
\frac{\text{ mols HCl inicials – mols HCl neutralitzats}} {\text{Volum total dissolució}}=\frac{ 5-1 } {60 }=\frac{1}{15}M
\\
pH=-log[ H^+]=1.17
\\[0.5cm]
\begin {Bmatrix}
\text{mols HCl inicials}=0,1N \cdot 50,00ml=5 \\
\text{mols NaOH neutralitzats}=0,1N \cdot \text{V afegit NaOH}\\
\text{Volum total dissolució}=50,00ml+\text{V afegit NaOH}
\end {Bmatrix}
\\[1cm]
\text{3. En afegir-hi 25,00 ml de base:}
\\[0.5cm]
[ HCl ]= [H^+ ]\frac {\text{mols HCl restants en dissolució}} {\text{Volum total dissolució}}=
\\
\frac{\text{mols HCl inicials} – \text{mols HCl neutralitzats}} {\text{Volum total dissolució}}=\frac{ 5-2,5 } {75,00 }=\frac{1}{30}M
\\
pH=-log(1/30)=1.48
\\[0.5cm]
\begin {Bmatrix}
\text{mols HCl inicials}=0,1N \cdot 50,00ml=5
\\
\text{mols HCl neutralitzats}=0,1N \cdot \text{V afegit NaOH}=2,5 \text{ mols}
\\
\text{Volum total dissolució=50,00ml+V afegit NaOH}
\end {Bmatrix}
\\[1cm]
\text{4. En el punt estequiomètric:}
\\[0.5cm]
M_{HCl} \cdot V_{HCl}=M_{NaOH} \cdot V_{NaOH} \rightarrow V_{NaOH}=\frac{0.1M \cdot 50,00 ml}{0.1}=50,00 ml NaOH
\\
pH=7 ([H_3O^+]=[OH^-])
\\[1cm]
\text{5. Després del punt estequiomètric: es calcula el pH per l’excés de NaOH afegit.}
\\
\\ \text{Havent afegit 60,00 ml de NaOH:}
\\
pH=14-pOH=14+log(\frac{0.1 \cdot 10.00 \enspace ml}{110\enspace ml})=12
\\
\\
\text{Els càlculs de la valoració d’una base feble amb un àcid fort són similars als anteriors.}
}
\)
Tens dubtes? Vols saber-ne més? T’agradaria que publiquéssim algun tema del teu interès? Has trobat algun error?
Envia’ns un comentari sense compromís i et respondrem tan aviat com ens sigui possible.








 RSS CEEdukat
RSS CEEdukat