Instruccions abans de començar
1. Introducció
La cinètica química és la branca de la química que estudia la velocitat i els mecanismes de reacció de les reaccions químiques en diferents condicions, mentre que la termodinàmica estudia en quin sentit es produirà la reacció.
L’estudi de la influència de diferents condicions ens dóna informació dels mecanismes i dels estats de tansició de les reaccions.
La velocitat d’una reacció és la variació de la concentració dels reactius i els productes en el temps. El 1864, Guldberg i Waage van descobrir que la velocitat d’una reacció química és proporcional a la concentració dels reactius. Foren els pioners de la cinètica química.
2. L’energia d’activació i el complex activat
\[aA+bB ⇌ cC+dD\]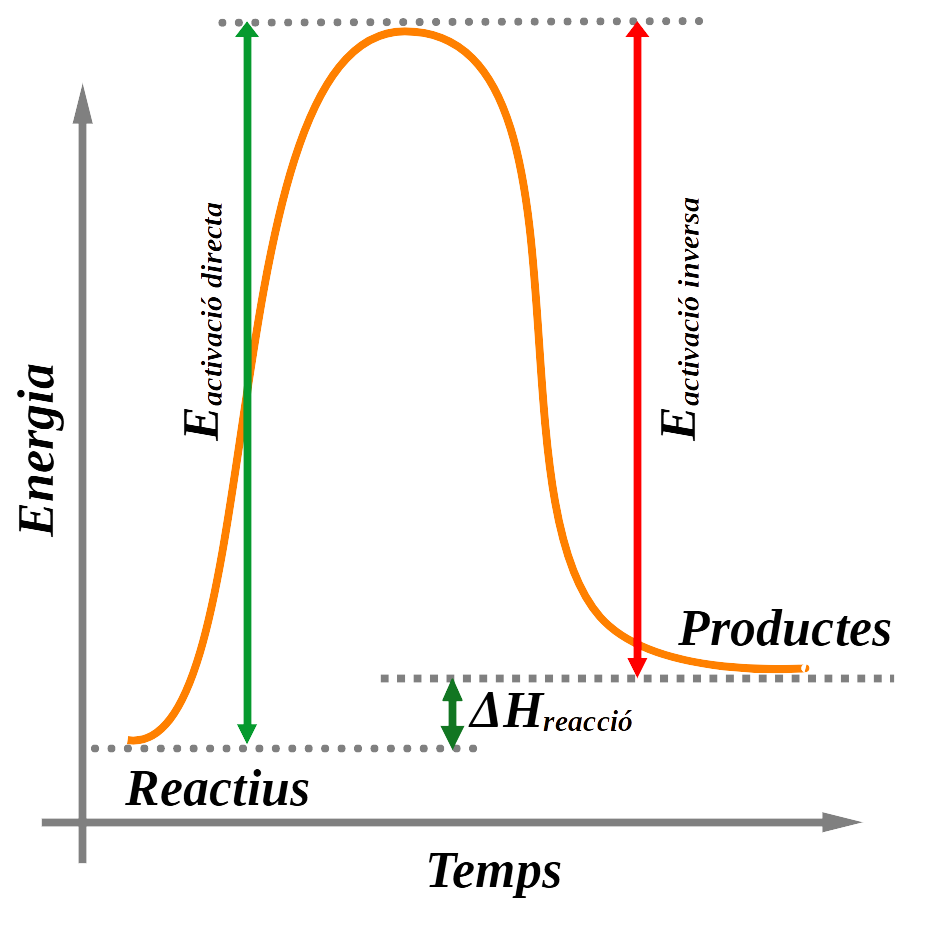
El complex activat és la configuració atòmica dels reactius en el punt de màxima energia de la reacció. Aquesta configuració és el punt de transició de la reacció, quan els reactius es transformen en els productes. Després d’aquest punt, l’energia de la reacció comença a minvar fins a estabilitzar-se en la dels productes.
La diferència entre l’energia del complex activat i la dels reactius és l’energia d’activació de la reacció directa. La diferència entre l’energia del complex activat i la dels productes és l’energia d’activació de la reacció inversa. És l’energia mínima que cal perquè es produeixi la reacció.
El gràfic anterior mostra com varia l’energia d’una reacció exotèrmica (l’energia dels productes és més petita que la dels reactius).
3. Mecanismes de reacció
El mecanisme d’una reacció són les reaccions en seqüència que transformen els reactius en productes. També descriu la termodinàmica i totes les característiques qualitatives i quantitatives de la reacció. És una descripció teòrica suportada per evidències experimentals que la confirmen.
Els reactius intermedis d’un mecanisme de reacció són espècies químiques inestables i vida curta que no són part de la reacció química global. Generalment, són radicals lliures o ions.
Cada etapa del mecanisme de reacció té una velocitat i molecularitat pròpies (nombre de molècules que reaccionen en una etapa). L’etapa més lenta del mecanisme de reacció determina la velocitat de la reacció global.
\[\mathbf {CH_4 +4Cl_2 ⇌ CCl_4 + 4HCl}
\\[0.5cm]
\mathbf{CH_4+Cl_2} ⇌ CH_3 Cl+HCl
\\
CH_3 Cl+Cl_2 ⇌ CH_2 Cl_2+HCl
\\
CH_2 Cl_2 + Cl_2 ⇌ CHCl_3 + HCl
\\
CHCl_3 + Cl_2 ⇌\mathbf {CCl_4 + HCl}
\]
La cinètica química i altres tècniques (com l’efecte de la temperatura i l’espectroscòpia, per exemple) ens serveix per a esbrinar la velocitat, l’ordre i el mecanisme d’una reacció.
4. Velocitat, constant i ordre de reacció
4.1 Velocitat de reacció
La velocitat mitjana d’una reacció és:
\[\displaystyle{
\bar v= -\frac { [A]_0 }{a \Delta t }=-\frac{ [B]_0 } {b \Delta t }=\frac{ [C] }{c \Delta t }=\frac{ [D] } {d \Delta t }
}
\]
I la velocitat en un moment determinat del temps és:
\[\displaystyle{
v_i=-\frac{1} {~a} \frac{[A]_0 } { dt }=-\frac{1} {~b} \frac {[B]_0 } { dt }=-\frac{1} {~c} \frac {[C] } { dt }=-\frac{1} {~d} \frac{[D] } { dt }
}
\]
L’equació de velocitat determina la velocitat instantània d’una reacció amb les concentracions inicials dels reactius en un moment del temps.
\[\displaystyle{
v_i=k \cdot [ A ]^\alpha_0 \cdot [ B ]^\beta_0
}
\]
L’energia lliure de Gibbs ens diu si una reacció es produirà o no, però no ens diu si serà ràpida o lenta. La velocitat d’una reacció la determina la cinètica química.
4.2 Constant de reacció (k)
La constant de velocitat és una constant de proporcionalitat que fa la igualtat de l’equació de velocitat. És específica de cada reacció i depèn de la temperatura (equació Arrhenius). S’ha de determinar experimentalment.
\[\displaystyle{
k=A \cdot e^{-\frac{ E_a } { RT }} \rightarrow \ln k=\ln A-\frac{ E_a } { RT }
}
\]
4.3 Ordres de reacció
L’ordre parcial de reacció d’un reactiu és l’exponent de la concentració d’aquest reactiu en l’equació de velocitat. L’ordre global de la reacció és la suma dels exponents de les concentracions dels reactius de l’equació.
\[\displaystyle{
v_i=k \cdot [ A ]^\alpha_0 \cdot [ B ]^\beta_0
}
\]
L’ordre global de l’equació anterior és \[\alpha+\beta\]
4.4 Variació de la velocitat de reacció
La velocitat de reacció depèn de la concentració, de la temperatura, dels catalitzadors i de la pressió, però també s’ha de tenir en compte la natura i l’estat físic dels reactius:
4.4.1 Concentració
Les col·lisions de les molècules dels reactius determinen la velocitat d’una reacció. Si la concentració és més alta, hi haurà més col·lisions i, per tant, la velocitat augmentarà.
4.4.2 Temperatura
La temperatura afecta molt la velocitat de reacció. Com més alta sigui, més gran serà l’energia tèrmica de les molècules. Això farà augmentar en nombre de col·lisions i conseqüentment, la velocitat de la reacció.
Segons Arrhenius, la constant de la velocitat de reacció, és funció de la temperatura i de l’energia d’activació:
\[\displaystyle{
k=A \cdot e^{-\frac{ E_a } { RT }}
}
\]
4.4.3 Catalitzadors
La presència de catalitzadors canvien el mecanisme de reacció i fan minvar l’energia d’activació, tot i que es manté la termodinàmica de la reacció. Els catalitzadors resten inalterats al final de la reacció, malgrat que perden activitat amb el temps.
4.4.4 Pressió
En augmentar la pressió augmenta la quantitat de col·lisions entre els reactius i això fa augmentar la velocitat de reacció.
4.4.5 Natura i estat físic dels reactius
La velocitat de reacció també depèn de la natura i de l’estat físic dels reactius: les reaccions iòniques són més ràpides que les de formació d’enllaços covalents i l’estat físic fa que l’eficàcia de les col·lisions depengui de l’àrea de contacte dels reactius.
Exemples
Determinació de l’equació de velocitat
\[\displaystyle{
\begin {matrix}
Essaig & {}:{} & [CH_3 Cl]_0 & {}:{} & [H_2 O]_0 & {}:{} & \text{ velocitat reacció}
\\
1 & {}:{} & 0,25 & {}:{} & 0,25 & {}:{} & 2,83
\\
2 & {}:{} & 0,25 & {}:{} & 0,50 & {}:{} & 11,35
\\
3 & {}:{} & 0,50 & {}:{} & 0,25 & {}:{} & 5,675
\end {matrix}
\\[2cm]
\text{ L’equació de la velocitat de reacció es:}
\\[0.5cm]
v=k \cdot [ CH_3 Cl ]^\alpha _0 \cdot [ H_2 O ]^\beta _0
\\[0.5cm]
\text{ Per a definir l’equació de la reacció anterior hem de trobar la constant i }
\\
\text{els ordres parcials de la reacció:}
\\[0.5cm]
\text{ Calcularem l’ordre } \beta \text{ eliminant l’ordre } \alpha:
\\[0.5cm]
v_1=k \cdot 0,25^\alpha \cdot 0,25^\beta
\\
v_2=k \cdot 0,25^\alpha \cdot 0,50^\beta
\\
\frac{ v_1 } { v_2 }=\frac{ k \cdot 0,25^\alpha \cdot 0,25^\beta } { k \cdot 0,25^\alpha \cdot 0,50^\beta }=\frac{ 0,25^\beta } { 0,50^\beta }\rightarrow \frac{ 2,83 } { 11,35 }=( \frac{0,25} {0,50} )^\beta\rightarrow ln 0,25=\beta \cdot ln 0,50\rightarrow \beta=2
\\[1cm]
\text{ Calcularem l’ordre } \alpha \text{ eliminant l’ordre } \beta:.
\\[0.5cm]
v_1=k \cdot 0,25^\alpha \cdot 0,25^\beta
\\
v_3=k \cdot 0,50
\frac{ v_1 } { v_3 }=\frac{ k \cdot 0,25^\alpha \cdot 0,25^\beta } { k \cdot 0,50^\alpha \cdot 0,25^\beta }=\frac{ 0,25^\alpha } { 0,50^\alpha }\rightarrow \frac{ 2,83 } { 5,675 }=( \frac{0,25} {0,50} )^\alpha
\\
ln 0,50=\beta ln 0,50 \rightarrow \alpha=1
\\[1cm]
\text{ Per acabar, determinem la k:}
\\[1cm]
v_1=k \cdot 0,25^\alpha \cdot 0,25^\beta\rightarrow2,83=k \cdot ( 0,25 )^1 \cdot ( 0,25 )^2
\\[0.5cm]
k=\frac{ 2,83 } { (0.25)^1 \cdot (0,25)^2 }={181.12 ~mols^{-3}.L^{4}.s^{-1} }
\\[1cm]
\text{Per tant,}
\\[1cm]
\mathbf{v=181.12[A]_0[B]_0^2}
}
\]
Determinació de la variació de l’energia d’activació d’una reacció
En una reacció química, la constant de velocitat es triplica si la temperatura
augmenta de 270 K fins a 308 K. Calcula l’energia d’activació de la reacció.
\displaystyle{
k=A \cdot e^{ -\frac{E_a} {RT} }
\\
\\
k_{270}=A \cdot e^{ -\frac{E_a} {R\cdot 270} }, k_{308}=A \cdot e^{ -\frac{E_a} {R\cdot 308} }
\\
\frac{k_{308}} {k_{270}}=\frac{A \cdot e^{ -\frac{E_a} {R.\cdot 308} }} {A \cdot e^{ -\frac{E_a} {R.\cdot 270}}
}\rightarrow
3=e^{ -\frac{E_a} {R\cdot 308}+\frac{E_a} {R.\cdot 270}}
\\
ln 3=-\frac{E_a} {8,314 \cdot 308}+\frac{E_a} {8,314 \cdot 270}
\\
ln 3 \cdot (8,314 \cdot 270 \cdot 8,314 \cdot 308)=-8,314 \cdot 270 E_a+8,314 \cdot 308 E_a
\\
E_a=\frac{ln 3 \cdot (8,314 \cdot 270 \cdot 8,314 \cdot 308)} {-8,314 \cdot 270+8,314 \cdot 308}=\mathbf {19 988.737J}
}
\]

 RSS CEEdukat
RSS CEEdukat