Instruccions abans de començar
1. Estat i condicions estàndard
L’estat estàndard d’una substància pura és un estat de referència descrit amb variables intensives que no inclou la temperatura. Es descriu amb el símbol º o ⊖:
- Per a un gas, la condició d’estat estàndard és que compleixi l’equació dels gasos ideals a la pressió d’1 bar.
- Les condicions estàndard d’un sòlid o un gas en una solució ideal diluïda són una concentració 1M a la pressió d’1 bar.
- Les condicions estàndard d’un element són que estigui en la forma més estable a 1 bar de pressió.
- Per als ions en solució aquosa l’estat estàndard és quan la concentració d’ions H+ és 1M.
Les condicions de pressió i temperatura estàndard (STP) de mesura són condicions experimentals establertes arbitràriament per tal de poder comparar dades termodinàmiques en condicions diferents. La IUPAC les estableix a 273,15 K i 1 bar de pressió (100 kPa) i NIST a 298,15 K i un bar de pressió, tot i que hi ha altres convencions.
2. Entalpia
L’entalpia és una funció d’estat termodinàmica que mesura el contingut energètic d’un sistema a pressió constant \[(\Delta H=\Delta U-P \cdot \Delta V).\] El terme \[P \cdot \Delta V\] és molt petit per a sòlids i líquid perquè són incompressibles.
L’entalpia és la suma de totes les energies del sistema (d’enllaç, de solvatació, etc.). En calculem la variació i no pas el valor absolut perquè l’energia interna és difícil de mesurar.
Les substàncies tenen un contingut energètic o entalpia que varia en les reaccions químiques.
2.1 Entalpia de formació de substàncies pures
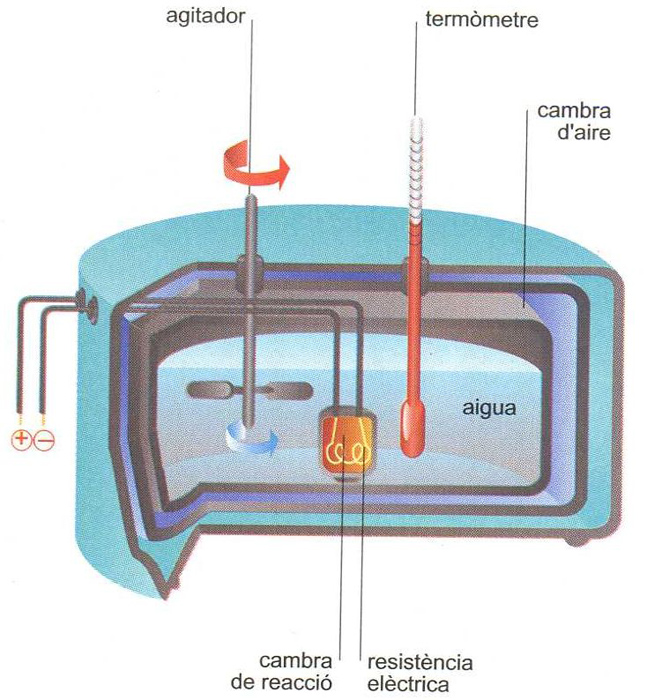
L’entalpia estàndard de formació d’una substància pura és l’energia que cal per a formar-ne un mol a partir dels elements que la formen en condicions d’estat estàndard.
Establim que l’entalpia o contingut energètic d’un element és zero en condicions d’estat estàndard. En assignar arbitràriament entalpia zero a la formació dels elements, la mesura de la calor despresa de la reacció amb un calorímetre és l’entalpia de formació del compost. La mesura es fa determinant la variació de la temperatura de la reacció:
\[q=m \cdot c_e \cdot \Delta T\]Les entalpies de formació d’una substància pura determinades es tabulen per mol de substància formada per a fer-les servir en la determinació de l’entalpia d’una reacció.
Exemple
\[C( grafit ) +2S( s ) \rightarrow CS_2(l) \, \Delta H_{formació}=86.3 KJ
\\[0.5cm]
\Delta H^0_f [C(grafit )]=0 KJ.mol^{ -1 }
\\
\Delta H^0_f [S(s )]=0 \,KJ.mol^{ -1 }
\\[0.5cm]
\Delta H^0_{reacció}=\Delta H^0_f [CS_2(l)]=\Delta H^0_f CS_2(l)-[\Delta H^0_f C( grafit )+2 \Delta H^0_f S( s )]=86.3KJ
\]
2.2 Entalpia de les reaccions
L’entalpia estàndard de reacció és la variació d’entalpia de la reacció quan totes les substàncies són en estat estàndard.
Si la reacció desprèn calor (\[ΔH_r<0\]), la reacció és exotèrmica. Si li hem de subministrar calor perquè es produeixi (\[ΔH_r>0\]), és endotèrmica.
Quan la reacció és entre sòlids i líquids, la variació de volum de la reacció és petita i l’entalpia és igual a l’energia interna:
\[\Delta U=q+w=q_p+w=\Delta_r+w=\Delta H_r\]Si la reacció és entre gasos, haurem de tenir en compte la llei dels gasos ideals:
\[\Delta H_r=\Delta U-P \cdot T \Delta V=\Delta U-\Delta n \cdot R \cdot T\]2.3 Càlcul de l’entalpia de reacció
- Usant la taula de les entalpies de formació de les substàncies:
- Usant la taula de les energies d’enllaç de les substàncies:
Exemple
\[C-H : 414 KJ/mol, \,Cl-Cl:243 KJ/mol, \,C-Cl:339 KJ/mol,
\\H-Cl:431 KJ/mol
\\[0.5cm]
\text{a. Escriviu la reacció de cloració del metà}
\\
\text{b. Quina és l’entalpia estàndard de la reacció de cloració del metà?}
\\[0.5cm]
a. CH_4+4Cl_2 \, \rightarrow \, CCl_4 + 4HCl
\\
b. \Delta H_{reacció}=\Delta H_{enllaços \,trencats \,productes}-\Delta H_{ enllaços \,formats \,reacctius }
\\
\Delta H_{reacció}=[\Delta H(4 \cdot C-H+4 \cdot Cl-Cl )]-[\Delta H( 4 \cdot C-Cl )+4 \cdot H-Cl]
\\
\Delta H_{reacció}=(4 \cdot 414+4 \cdot 243)-( 4 \cdot 339+4 \cdot 431 )=\mathbf {-452KJ}
\]
L’entalpia d’enllaç és l’energia continguda en els enllaços atòmics d’una molècula.
Per a trencar l’enllaç dels reactius cal subministrar energia. Quan es formen els nous enllaços dels productes, es desprèn energia perquè termodinàmicament són més estables.
Exemple
\[\displaystyle{
\text{L’entalpia estàndard de la combustió del butà és
de – 2 660 kJ/mol.}
\\[0.5cm]
\text{a. Formuleu l’equació termoquímica de la combustió del butà}
\\
\text{b. Quina quantitat de calor es desprèn en la combustió d’1} m^3 \text{ de butà}
\\
\text{ en condicions estàndard?}
\\
\text{c. Calculeu la variació d’energia interna global del procés}
\\[0.5cm]
\text{RESOLUCIÓ}
\\[0.5cm]
a. \,2C_4 H_{10} + 13O_2 \, \rightarrow \, 8CO_2 + 10H_2 O
\\
b. \,n_{butà}=\frac{ P \cdot V }{ R \cdot T }=\frac{ 1atm \cdot 1m³ }{ 0.082 \cdot 298K }=0.041 \text{ mols butà}
\\
0.041 \text{ mols butà} \cdot \frac{-2 660 KJ }{ 1 \text{ mol butà}}=\mathbf {-109.06 KJ}
\\
c. \,\Delta H=\Delta U – \Delta n \cdot R \cdot T \,\rightarrow \, \Delta U=\Delta H + \Delta n \cdot R \cdot T
\\
\Delta U=-109 060+(18-15) \cdot 8.314 \cdot 298=\mathbf {-101 627.28 J}
}
\] \[
\displaystyle{
\text{La combustió d’un mol de propà a 298K i 1.01×10⁵ Pa desprèn 2 220KJ.}
\\[0.5cm]
\text{a. Escriviu i igualeu la reacció i indiqueu la quantitat d’energia en forma de calor}
\\
\text{que s’obtindrà en la combustió de 154g de propà.}
\\
\text{b. Calculeu la massa d’aigua sòlida (gel) a -10ºC que pot escalfar-se}
\\
\text{fins a la temperatura de 80ºC si es cremen 154g de propà.}
\\[0.5cm]
M(C)=12g/mol, \,M(H)=1g/mol, \lambda_{fusió} (gel)=334 KJ/Kg,
\\
c_e (gel)= 2 090 J.kg^{-1}. k^{-1}, \,c_e (aigua)= 4 180 J kg^{-1} k^{-1}.
\\[0.5cm]
\text{RESOLUCIÓ:}
\\[0.5cm]
a. \,2C_3 H_8 + 10O_2 \,\rightarrow \, 6CO_2 + 8H_2 O \, \Delta H_r=2 220 KJ.Kg^{ -1 }.K^{ -1 }
\\[0.5cm]
1 \text{mol propà}=3 \cdot 12+8 \cdot 1=44 \, g.mol^{ -1 } \,\rightarrow \, 154 \text{ g propà} \cdot {\frac{\text{1 mol propà}}{ 44 \text{ g propà}}}=3.5 \text{mols propà}
\\
3.5 \text{ mols propà} \cdot {\frac {2 220 KJ}{ \text{1 mol propà}}}=\mathbf {7 770 KJ}
\\[0.5cm]
b.
\\
q_1(-10ºC \rightarrow 0ºC_{sólid})=m.c_e (gel).\Delta T=m \cdot 2 090 \cdot [ 0-(-10) ]=20 900m
\\
q_2( 0ºC_{sòlid} \rightarrow 0ºC_{líquid} )=m.\lambda_{gel}=m \cdot 334 000=334 000m
\\
q_3( 0ºC_{líquid} \rightarrow 80ºC_{líquid} )=m.c_e( aigua ).\Delta T=m \cdot 4 180 \cdot (80-0)=334 000m
\\
\\
q_1+q_2+q_3=688 900m=7 770 000
\\
m=\frac{7 770 000 }{ 688 900 }=\mathbf{11.28 \text{Kg de propà}}
}
\]
3. Lleis de Hess
La llei de Hess diu que la calor bescanviada en una reacció química a pressió o volum constant és la mateixa si la reacció es fa en un sola etapa o en diferents etapes. De fet, si això no fos cert, violaria la primera llei de la termodinàmica de conservació de l’energia.
Podem determinar-la de manera experimental amb un calorímetre, però no és possible quan es produeixen processos intermedis. Però, si coneixem l’entalpia d’aquests processos, podem calcular-la mitjançant la llei de Hess.
Exemple
\[\displaystyle{
\text{Calcula l’entalpia estàndard de la reacció de síntesi del disulfur de
carboni, } CS_2 (l)
\\
\text{a partir dels seus elements, } C (grafit),S(s), \text{ sabent que:}
\\[0.5cm]
\begin {matrix}
C( grafit ) + O_2(g) \rightarrow CO_2( g ) & {}:{} & \Delta H=-393.5 KJ
\\
S( s ) + O_2 ( g ) \rightarrow SO_2 &{}:{}& \Delta H=-296.1 KJ
\\
CS_2(l)+ 3O_2 (g) \rightarrow CO_2(g) + 2 SO_2( g ) &{}:{}& \Delta H=-1 072 KJ
\end {matrix}
\\[1cm]
\text{RESOLUCIÓ:}
\\[0.5cm]
\text{La reacció de formació del }CS_2( l )\text{ és: C( grafit ) + 2S( s )} \rightarrow \, CS_2( l )
\\[0.5cm]
\text{Multiplicant la segona equació per dos, canviant de signe la tercera i sumant-les totes:}
\\[0.5cm]
\begin {matrix}
C( grafit ) + O_2(g) \rightarrow CO_2( g ) &{}:{}& \Delta H=-393.5 KJ
\\
2S( s ) + 2 O_2 ( g ) \rightarrow {2SO_2(g)} &{}:{}& \Delta H=-592.2 KJ
\\
CO_2(g) + {2SO_2( g )} \rightarrow CS_2(l)+ {3O_2 (g)} &{}:{} & \Delta H=+1 072 KJ
\\
\mathbf {C( grafit ) +2S( s ) \rightarrow CS_2(l)} &{}:{}& \mathbf{\Delta H=86.3 KJ}
\end{matrix}
}
\]
4. Cicle de Börn-Haber
El cicle de Börn-Habber és un cicle de reaccions per a calcular l’energia reticular o de xarxa dels sòlids iònics cristal·lins (\[U_r\] ) a partir dels seus ions en estat gasós.
Com que no és possible mesurar-la directament, es calcula aplicant la llei de Hess a un cicle termodinàmic, l’expressió global del qual és:
\[nM^{+n} (g)+ nX^{-m}(g) \overset{U_r}{\rightarrow} M_mX_n(s)\]L’entalpia de formació del sòlid iònic que volem emprant la seqüència de cicle de Börn-Habber és:
Els passos del cicle de Börn-Habber són:
- Atomització del metall: \[M_{(s)} \rightarrow M_{(g)} + \Delta H_{sublimació}\]
- Ionització del metall: \[ M_{(g)} \rightarrow M^{+}_{(g)} + e^{-} + \Delta H_{potencial \, ionització}\]
- Atomització del no metall: \[\frac {1}{2} X_2 (g) \rightarrow X(g) + \Delta H_{dissociació}\]
- Ionització del no metall: \[X_{(g)} + e^{-} \rightarrow X^{-}_{(g)} + \Delta H_{afinitat \, electrònica}\]
- Formació del sòlid iònic a partir dels ions: \[M^{+}_{(g)} + X^{-}_{(g)} \rightarrow MX_{(s)} + \Delta H_{reticular}\]
Per tant, sumant totes les equacions s’obté que:
\[{M(s)+ \frac{1}{2} X_2 \rightarrow MX(s) +\Delta H_f
\\
(\Delta H_f=\Delta H_{sublimació}+\Delta H_{p. \, ionització}+\Delta H_{dissociació}+\Delta H_{a. \, electrònica}+\Delta H_{reticular})
\\[0.5cm]
\Delta H_{reticular}=\Delta H_{formació}-(\Delta H_{sublimació}+\Delta H_{p. \, ionització}+\Delta H_{dissociació}+\Delta H_{a. \, electrònica})
}
\]
Per a arrancar electrons d’un element cal saber-ne l’energia d’ionització, i per a afegir-n’hi l’afinitat electrònica.
Exemple
\[\small{
\text{Calcula la energía reticular del NaCl a partir dels seus elements en estat estàndard sabent que la reacció}
\\
\text{desprèn -410,7 kJ.}
\\
\text{DADES:}
\\[0.5cm]
\Delta H_{sublimació} (Na) = 109 kJ/mol; \Delta H_{ionització} (Na) = 494 kJ; \Delta H_{dissociació} (Cl_2) = 244 kJ/mol
\\
\Delta H_{afinitat electrónica} (Cl) = – 348 kJ/mol
\\[0.5cm]
\text{RESOLUCIÓ:}
\\[0.5cm]
\begin{matrix}
\text{Reacció de formació del clorur de sodi} & {}:{} & Na( s ) + \frac{1}{2} Cl_2( g )
\\[0.5cm]
\text{2. Ionització del metall} & {}:{} & Na( g ) \rightarrow Na^{+}( g ) + \Delta H_{ionització } >0
\\
\text{3. Atomització del no metall} & {}:{} & \frac{1} {2} Cl_2( g ) \rightarrow Cl( g ) + \Delta H_{dissociació}>0
\\
\text{4. Ionització del no metall} & {}:{} & Cl( g ) + e^{-} \rightarrow Cl^{-}( g ) + \Delta H_{afinitat electrónica}<0
\\
\text{5. Formació del sólid iònic a partir dels ions} & {}:{} & Na^{+}( g ) + Cl^{-}(g) \rightarrow NaCl(s) + \Delta H_{reticular} <0
\end{matrix}
\\[2cm]
\Delta H_{formació}=\Delta H_{sublimació}+\Delta H_{ionització}+\Delta H_{dissociació}+\Delta H_{afinitat electrónica}+\Delta H_{reticular}
\\
\Delta H_{reticular}=\Delta H_{formació}-\Delta H_{sublimació}-\Delta H_{ionització}-\Delta H_{dissociació}-\Delta H_{afinitat electrónica}
\\
\mathbf{\Delta H_{reticular}=-410.7-109-494-\frac{1}{2} 244+348=-787.7KJ/mol}
}
\]

 RSS CEEdukat
RSS CEEdukat

Quant a l'autor